
Lo stress preconcezionale può influire negativamente sulla glicemia
Lo stress psicologico si associa a una glicemia anormale, portando ad un aumento del rischio di glicemie anormali fino al 135 più alto
Un articolo pubblicato sul “Journal of the Endocrine Society” e firmato dai ricercatori del Massachusetts General Hospital e del Brigham and Women’s Hospital, suggerisce che è importante valutare l’effetto sulla glicemia non solo dello stress in gravidanza, ma anche di quello pregravidico.
«La prevalenza dello stress è aumentata nel corso degli anni, tanto che il National Study of Daily Experiences mostra livelli di stress più elevati nel 2010 rispetto agli anni ’90» afferma il coordinatore dello studio Jorge Chavarro del Dipartimento di epidemiologia alla Harvard TH Chan School of Public Health di Boston, ricordando che lo stress può influenzare il metabolismo del glucosio e che esistono differenze di genere nello stress percepito, con le donne che riportano livelli di stress autoriferito più elevati rispetto agli uomini.
Per approfondire i legami fra stress, gravidanza e livelli glicemici, gli autori hanno verificato l’eventuale associazione fra stress materno durante il periodo preconcezionale e glicemia in gravidanza in una coorte di donne arruolate nello studio prospettico EARTH (Environment and Reproductive Health), che aveva lo scopo di valutare i determinanti ambientali e dietetici della fertilità.
Tra il 2004 e il 2019 sono state selezionate 1.324 donne di età compresa tra i 18 e i 45 anni che cercavano cure per la fertilità presso il Massachusetts General Hospital Fertility Center, di cui 991 arruolate prima del concepimento.
«Questa analisi include 398 donne che hanno riferito di aver percepito stress preconcezionale all’ingresso nello studio EARTH e di aver misurato i livelli di glucosio in gravidanza» spiegano gli autori, che hanno anche valutato se le associazioni tra stress e glicemia variavano in base alla modalità di concepimento, ossia inseminazione naturale, intrauterina [IUI] e fecondazione in vitro [IVF].
I dati raccolti suggeriscono che lo stress psicologico si associa positivamente a una glicemia anormale. In particolare, le glicemie medie nel primo, secondo e terzo terzile di stress psicologico erano rispettivamente 115, 119 e 124 mg/dL.
Inoltre, le donne nel secondo e terzo terzile di stress psicologico avevano maggiori probabilità, rispettivamente il 4% e il 13% di glicemie anormali rispetto al primo tezile.
Non solo: le donne che hanno concepito con IUI avevano livelli di stress e glicemia più alti rispetto alle coetanee che avevano concepito con IVF.
«Ciò può essere spiegato dal fatto che l’IUI sembra essere meno efficace rispetto all’ IVF, generando un maggiore disagio» ipotizza Chavarro.
– Journal of the Endocrine Society 2024-

Menopausa: oli essenziali di menta piperita e limone efficaci sui sintomi
Uno studio ha indagato l’effetto del massaggio aromaterapico con olio essenziale di menta piperita e limone sui sintomi della menopausa
Le donne in menopausa e postmenopausa soffrono di molti sintomi fisici e psicologici. Uno studio ha indagato l’effetto del massaggio aromaterapico con olio essenziale di menta piperita e limone sui sintomi della menopausa.
In questo studio sono state incluse un totale di 63 donne in menopausa e postmenopausa. Le partecipanti sono state randomizzate in tre gruppi: Menta piperita (n = 21), Citrus lemon (n = 21) e Placebo (n = 21).
Gli oli essenziali di menta piperita e limone dei gruppi di intervento sono stati diluiti con olio di mandorle dolci all’ 1,5%. Nel gruppo placebo è stato utilizzato olio di mandorle dolci puro.
Ogni partecipante ai gruppi di massaggio ha ricevuto un massaggio alle mani e alle braccia con l’olio selezionato due volte a settimana per 4 settimane in sessioni di 30 minuti.
I sintomi della menopausa delle partecipanti sono stati valutati prima e dopo l’applicazione utilizzando la Menopause Syntoms Rating Scale (MRS).
Risultati: quando sono state esaminate le differenze nei gruppi di trattamento in base al tempo, si è riscontrato che c’erano differenze statisticamente significative nell’olio essenziale al limone (F = 9,561 p = 0,003 n2 =0,139) e olio essenziale di menta piperita (F = 15,687 p = 0,001 n2 = 0,210) raggruppati in base al tempo.
Il gruppo dell’olio essenziale di menta piperita si è rivelato più efficace del gruppo del limone. Inoltre, sia gli oli essenziali di menta piperita che quelli di limone si sono rivelati efficaci sui sintomi somatici (p < 0,05). Per i sintomi psicologici si è rivelato efficace solo l’olio di limone (p = 0,011) e per i sintomi urogenitali solo l’olio essenziale di menta piperita ( p= 0,001).
Conclusione: lo studio ha scoperto che il massaggio aromaterapico con olio essenziale di menta piperita e limone riduce efficacemente i sintomi della menopausa. L’olio essenziale di menta piperita è risultato più efficace dell’olio essenziale di limone nel ridurre i sintomi della menopausa.
[ tratto da: ” The effect of aromatherapy massage with lemon and peppermint essential oil on menopausal symtoms: A double-blinded, randomized placebo controlled clinical trial” 2023 ]
(per info: Dott. Matti Nicolò 333/1442457)

Nelle donne con sindrome dell’ovaio policistico l’obesità aumenta il rischio di diabete gestazionale
La sindrome dell’ovaio policistico è una sindrome comune in età riproduttiva, una nuova ricerca dimostra l’importanza di questa patologia nello sviluppo del diabete gestazionale e del controllo dell’insulina.
Secondo uno studio pubblicato sul Journal of Obstetrics and Gynaecology Canada, nelle pazienti con sindrome dell’ovaio policistico (PCOS) la compresenza di obesità aumenta in modo significativo la probabilità di sviluppare un diabete gestazionale (GDM).
«La PCOS è un’endocrinopatia comune nelle donne in età riproduttiva, che spesso presentano anovulazione, iperandrogenismo, obesità, sindrome metabolica e infertilità» esordisce Maria Velez, professore associato di ostetricia e ginecologia alla Queen’s University di Kingston (Canada), coordinatrice della ricerca.
Gli autori precisano che la resistenza all’insulina è comune nelle donne con PCOS e può svolgere un ruolo centrale nella patogenesi del GDM, che si verifica in circa il 20% delle gravide affette da PCOS. Inoltre, la sindrome dell’ovaio policistico è spesso associata a un eccessivo incremento ponderale, tanto che il 60% delle donne con PCOS presenta sovrappeso o obesità.
«Ciononostante, non è ancora chiaro l’effetto della PCOS sullo sviluppo di GDM nè il ruolo dell’obesità» scrivono gli autori, aggiungendo che secondo una recente metanalisi la PCOS è un fattore di rischio per il GDM indipendentemente dall’obesità. Viceversa, un ampio studio statunitense limitato alle donne con PCOS conclude che l’obesità è importante nell’aumentare le probabilità di GDM. «Il nostro studio aveva l’obiettivo di valutare l’effetto dell’obesità pre-gravidica sull’associazione tra PCOS e rischio di GDM» chiarisce Velez, che assieme ai coautori ha analizzato 1.268.901 nascite tra il 2006 e il 2018: 387.748 erano con PCOS materna e 881.153 senza.
«L’analisi statistica ha evidenziato che le donne con PCOS rispetto a quelle senza avevano un tasso più elevato di GDM, e che la presenza di obesità ha mediato una percentuale significativa (90%) di questa associazione» affermano i ricercatori, sottolineando che le donne con PCOS corrono un rischio più elevato, ma solo il 5% più alto rispetto alla popolazione generale, che tuttavia aumenta in modo considerevole con l’obesità.
Conclude Velez. «Da questi risultati emerge l’importanza di ottimizzare il peso, iniziando con modifiche dell’alimentazione associate a un aumento dell’esercizio fisico».
_Journal of Obstetrics and Gynaecology 2023_

Svolgere attività fisica invece di guardare la televisione riduce il rischio di diabete mellito gestazionale
Basta un’ora di esercizio fisico vigoroso alla settimana per ridurre significativamente il rischio di sviluppare il diabete mellito gestazionale
Nelle gestanti la semplice sostituzione di un’ora alla settimana trascorsa guardando la televisione con un analogo intervallo in cui svolgere un esercizio fisico vigoroso (VPA) si associa a una significativa riduzione delle probabilità di sviluppare un diabete mellito gestazionale (GDM), secondo uno studio pubblicato su Gynecology and Obstetrics coordinato da José Juan Jiménez-Moleón del Dipartimento di medicina preventiva e sanità pubblica all’Università di Granada in Spagna.
«É noto che l’attività fisica previene il GDM, ma resta da chiarire quale sia il tipo più efficace di esercizio e quali strategie per prevenire il GDM siano efficaci, dato che gli studi svolti in precedenza non hanno probabilmente raggiunto i livelli minimi di attività fisica necessari a ridurre il rischio di GDM» affermano gli autori, ricordando che in una giornata di 24 ore dedicare tempo a un’attività può sostituirne un’altra, influenzando in tal modo altre patologie come la depressione e il diabete di tipo 2.
«Sebbene un modello tradizionale non consideri le differenze prodotte dalla riallocazione di comportamenti, il modello di sostituzione isotemporale consente di valutare l’effetto della sostituzione di un’attività con un’altra, e a nostra conoscenza questo è il primo studio che valuta l’effetto della sostituzione del tempo trascorso alla televisione con l’attività fisica sul rischio di GDM» riprende Jiménez-Moleón. E aggiunge: «Considerando che le gestanti tendono a ridurre l’attività fisica trascorrendo più tempo in comportamenti sedentari, abbiamo stimato l’effetto della sostituzione di un’ora la settimana trascorsa alla televisione con un tempo equivalente di attività fisica prima e durante la gravidanza sul rischio di GDM».
Ogni attività è stata classificata in base all’intensità; meno di 6 equivalenti metabolici (MET) era attività da lieve a moderata mentre 6 MET o più erano VPA. «E i dati raccolti confermano da un lato che le gravide che trascorrono più tempo alla televisione hanno maggiori probabilità di sviluppare GDM, e dall’altro che sostituire in gestazione ogni settimana un’ora di televisione con un’ora di VPA può ridurre il rischio di GDM» concludono i ricercatori.
_ Gynecology and Obstetrics 2023 _

Vivere in aree in cui si può facilmente camminare riduce rischio tumori legati all’obesità
Le donne che risiedono in luoghi in cui si può camminare hanno un rischio inferiore di tumori correlati ad obesità, nello specifico tumore al seno post menopausa, ma anche tumore delle ovaie, cancro dell’endometrio e mieloma multiplo. E’ la conclusione cui è arrivata una ricerca condotta da un team della Columbia University e della NYU Grossman School of Medicine. I risultati dell’indagine sono stati pubblicati su Environmental Health Perspectives.
Per la ricerca , sono state prese in considerazione 14.274 donne tra i 34 e i 65 anni, seguite per quasi tre decenni.
Il team ha misurato la capacità di camminare all’aria aperta nelle vicinanze di casa. Del numero totale di donne, il 18% ha avuto un tumore correlato all’obesità. Il più comune è stato il cancro del seno post menopausa, al 53%, seguito dal tumore del colon retto, il 14%, e dal tumore dell’endometrio, al 12%.
Le donne che vivevano in aree con la più elevata percentuale di aree percorribili a piedi nelle vicinanze, però, avevano un rischio ridotto del 26% di tumore correlato all’obesità rispetto a quelle che vivevano in zone meno percorribili a piedi.
[tratto da Popular Science]

Massa e forza muscolare: le insidie della sarcopenia per la nostra salute
L’invecchiamento non è amico dei nostri muscoli. Già a partire dai 40 anni, soprattutto nei soggetti sedentari, inizia a farsi strada la sarcopenia, una condizione caratterizzata dalla perdita progressiva di massa e forza muscolare (atrofia muscolare). Essa comporta sia un decadimento della forza che cambiamenti metabolici ed estetici sul nostro corpo.
Molti studi scientifici hanno messo in evidenza i primi segni di atrofia muscolare attorno ai 40 anni, periodo nel quale comincerebbe un lento declino funzionale.
Con l’affacciarsi della sarcopenia, inizia anche un abbassamento del dispendio energetico a riposo (metabolismo basale) anticamera dell’accumulo di grasso. Un fenomeno ulteriormente aggravato quando il regime alimentare è deficitario dal punto di vista dell’apporto proteico di qualità.
L’importanza di allenamento specifico e alimentazione
Come alcuni studi dimostrano, grazie a un allenamento specifico, la massa muscolare può essere mantenuta o addirittura aumentata anche dopo i 40 anni.
Non si tratta quindi di un mero fatto estetico: perdere muscoli significa non solo avere un corpo meno tonico ma soprattutto perdere autonomia e qualità della vita, favorendo lo sviluppo di patologie importanti.
Ma non tutto è perduto: ci sono diverse strategie e attività che possono aiutare a combattere la sarcopenia e a promuovere la salute muscolare.
Ecco alcune principali raccomandazioni da parte degli esperti
Esercizio fisico. L’esercizio regolare, in particolare l’allenamento di resistenza, è fondamentale per prevenire la sarcopenia. L’allenamento con i pesi o l’uso di macchine di resistenza aiuta a stimolare la crescita muscolare e il mantenimento della massa muscolare. La frequenza consigliata degli esercizi di resistenza è almeno due volte alla settimana, lavorando su tutti i principali gruppi muscolari.
Alimentazione adeguata. Una dieta equilibrata e ricca di nutrienti è importante per sostenere i nostri muscoli. Per questo è importante consumare una quantità sufficiente di proteine, i mattoni fondamentali per la costruzione e il mantenimento dei muscoli. Non possono quindi mancare fonti di proteine di alta qualità come carne magra, pesce, uova, latticini, legumi e noci. Ma anche una varietà di frutta, verdura e cereali integrali per fornire vitamine, minerali e antiossidanti che promuovono la salute muscolare.
Integrazione alimentare. Se l’alimentazione è carente di alcuni nutrienti, in alcuni casi può essere raccomandato l’apporto di integratori alimentari per sostenere la salute muscolare. Ad esempio le proteine, oppure la creatina per migliorare la forza muscolare e l’energia durante l’allenamento di resistenza.
Equilibrio fra attività fisica e riposo. Mentre l’esercizio regolare è importante, è altrettanto fondamentale concedere al corpo il giusto riposo e recupero. Durante il riposo, i muscoli si rigenerano e si riparano, favorendo la crescita e il mantenimento della massa muscolare. Assicurarsi di avere una buona qualità del sonno e di includere giorni di riposo attivo nella routine di allenamento.
Mantenere uno stile di vita attivo. Oltre all’allenamento strutturato, è importante mantenere uno stile di vita attivo nel quotidiano. Svolgere attività fisiche come camminare, salire le scale e fare giardinaggio può aiutare a stimolare l’attività muscolare e contrastare la sarcopenia
Fonte: Agemony

GRAVIDANZA. CON UN DIETOLOGO SI PRENDE MENO PESO
Da un’ampia analisi degli studi presenti in letteratura, è emerso che l’aumento di peso non fisiologico in gravidanza può essere meglio controllato con l’aiuto di un dietologo. La supervisione di un dietologo ha fornito maggiori evidenze di efficacia anche rispetto all’attività fisica, che comunque rimane consigliata, soprattutto se praticata in modo continuativo.
Le donne in gravidanza dovrebbero essere supportate da esperti in nutrizione per controllare l’aumento di peso e farlo rimanere nei limiti fisiologici. È la conclusione cui è giunta un’analisi che ha preso in considerazione quasi 100 studi pubblicati in letteratura. I risultati dell’indagine, coordinata da Shakila Thangaratinam dell’Università di Birmingham, nel Regno Unito, sono stati pubblicati da JAMA Network Open.
La metanalisi ha compreso quasi 35mila partecipanti e ha rilevato che gli interventi di professionisti sanitari come i dietologi sono gli strumenti più utili per controllare l’aumento di peso durante la gestazione. In particolare, sono raccomandabili tra i 6 e i 20 incontri individuali con l’esperto di nutrizione; queste sessioni devono prendere in considerazione anche elementi pratici della gravidanza, come la nausea – che può influenzare il corretto consumo degli alimenti – le “voglie” e la stanchezza.
Nell’analisi della letteratura il team ha evidenziato meno evidenze positive sull’attività fisica nella gestione del peso durante la gravdanza; in ogni caso un programma di esercizi motori deve essere seguito per più di 20 settimane.
“L’aumento di peso durante la gravidanza è un processo normale – conclude Thangaratinam – ma la convinzione che le mamme debbano mangiare per due e che non debbano preoccuparsi dell’aumento di peso può portare a conseguenze dannose per la salute di madre e bambino”.
L’eccessivo aumento di peso, infatti, porta a un maggior rischio di sviluppare diabete e altre complicanze.
Fonte: JAMA Network Open 2023
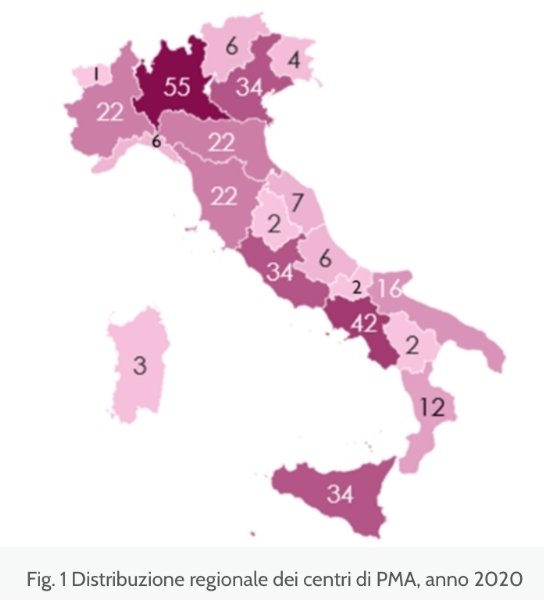
Evoluzione della natalità e cause di infertilità
Record negativo per la natalità in Italia: nel 2021 i nati sono 400.249, facendo registrare un calo dell’1,1% rispetto all’anno precedente. Le stime per il 2022 non sembrerebbero mostrare dati più confortanti, indicando un decremento di 6.000 nascite nei mesi di gennaio-settembre.
Sicuramente la variabile età riveste un ruolo chiave nell’evoluzione della natalità, infatti, si diventa genitori sempre più tardi, a causa di crisi (economiche, pandemiche) che hanno influito sulle scelte riproduttive della popolazione italiana. Nel periodo gennaio-ottobre 2021 la contrazione delle nascite ha riguardato soprattutto le donne in età più giovane, fino a 24 anni, e quelle in età avanzata (over 45 anni).
Per queste ultime si è assistito, nel bimestre novembre-dicembre 2021 a un picco che può essere correlato alla possibilità di aver potuto accedere alla procreazione medicalmente assistita (PMA), inibita nel periodo pandemico.
Le indicazioni di infertilità per le coppie trattate con tecniche PMA di I e II livello, nel 2020, sono state le seguenti:
- infertilità femminile: 44,1%
- infertilità maschile: 20,2%
- fattore sia maschile che femminile: 18,2%
- fattore genetico: 1,2%
- infertilità idiopatica: 16,3%
Principali tecniche di PMA
Le tecniche di procreazione medicalmente assistita possono essere suddivise in tre livelli, in base al grado di invasività della tecnica stessa. Di seguito una breve descrizione delle principali tecniche impiegate nei centri.
I LIVELLO
Inseminazione Intra Uterina (IUI): introduzione del seme maschile nella cavità uterina. La tecnica è eseguibile su ciclo spontaneo o su ciclo indotto mediante stimolazione farmacologica dell’ovulazione.
II LIVELLO
FIVET (Fecondazione in vitro e trasferimento dell’embrione). La tecnica prevede l’esecuzione delle seguenti fasi:
- stimolazione farmacologica delle ovaie
- prelievo degli ovuli
- fecondazione degli ovuli
- crescita dell’embrione in laboratorio
- impianto dell’embrione nell’utero
ICSI (Iniezione intracitoplasmatica di sperma): prevede l’iniezione di un solo spermatozoo in ciascun ovulo
FER: fecondazione con utilizzo di embrioni crioconservati
FO: fecondazione con utilizzo di ovociti crioconservati
III LIVELLO
GIFT (Trasferimento intratubarico dei gameti): prelievo di ovuli e spermatozoi attivi e successivo trasferimento nell’estremità della tuba di Falloppio mediante un’incisione nell’addome o attraverso la vagina.
Stato dell’Assisted Reproductive Technology
Dall’ultima relazione del Ministro della salute al Parlamento sullo stato di attuazione della Legge 40 del 2004 si ricava una fotografia dei dati inerenti alle tecniche di fecondazione assistita, con riferimento all’anno 2020.
I centri attivi in Italia risultano essere 322 di cui 101 pubblici, 20 privati convenzionati e 211 privati. Il maggior numero di essi si trova in Lombardia (55), Campania (42), Lazio (34), Sicilia (34) e Veneto (34).
Il merito alle coppie che hanno fatto ricorso a tecniche di PMA, si assiste a una contrazione del -16% rispetto al 2019 portando il totale delle coppie a 65.705. Una riduzione pressoché simile si evince dal numero di cicli effettuati che passa da 99.062 nel 2019 a 80.099 nel 2020 (-19%).
Se il numero di cicli diminuisce, la stessa tendenza non è rilevabile per l’età media delle pazienti che si sottopongono alle tecniche di fecondazione assistita che è sempre più alta rispetto al passato; questo porta inevitabilmente all’insorgenza di problematiche legate all’età materna più grande. Per quanto concerne le tecniche di primo livello, l’età media è di 34,9 anni; per quelle di secondo e terzo livello, più invasive rispetto alle precedenti, l’età media sale a 36,9 anni.
Un dato interessante è sicuramente il numero di nati vivi da tecniche di PMA; 11.305 sono i bimbi nati grazie alle attività dei centri, la maggior parte (9.158) con gameti della coppia e 2.147 con gameti donati.
Legge 40/2004 ed evoluzioni normative
La legislazione nell’ambito delle tecniche di procreazione medicalmente assistita fa riferimento alla legge 40 del 1 febbraio 2004, nota come “Norme in materia di procreazione medicalmente assistita”, entrata in vigore il 10 marzo dello stesso anno.
L’obiettivo del legislatore è espresso già nell’articolo 1, dove si evince la finalità della legge, ovvero “favorire la soluzione dei problemi riproduttivi derivanti dalla sterilità o dalla infertilità umana” per la quale “è consentito il ricorso alla procreazione medicalmente assistita, alle condizioni e secondo le modalità previste dalla presente legge, che assicura i diritti di tutti i soggetti coinvolti, compreso il concepito”.
In merito alle fattispecie nelle quali è consentito il ricorso alla PMA, si citano i seguenti articoli:
Art. 1: il ricorso alla PMA è consentito qualora non vi siano altri metodi terapeutici efficaci per rimuovere le cause di sterilità o infertilità.
Art. 4: è vietato il ricorso a tecniche di procreazione medicalmente assistita di tipo eterologo. In merito all’articolo 4, la Sentenza della Corte costituzionale n. 162 dell’aprile 2014 ha ritenuto il divieto incostituzionale, in quanto lesivo del diritto all’autodeterminazione delle coppie sterili e infertili in relazione alle proprie scelte procreative.
Art. 5: possono accedere coppie di maggiorenni di sesso diverso, coniugate o conviventi, in età potenzialmente fertile, entrambi viventi.
Art. 14: numero massimo di 3 embrioni da formare e trasferire in utero successivamente, con un unico e contemporaneo impianto. Circa l’art. 14 la Sentenza della Corte costituzionale n.151 del 1° aprile 2009 ha dichiarato illegittime le parti “unico e contemporaneo impianto” e “non superiore a 3”.
Inserimento delle tecniche di PMA nei LEA (Livelli Essenziali di Assistenza)
“Nell’ambito dell’assistenza distrettuale, domiciliare e territoriale ad accesso diretto, il Servizio sanitario nazionale garantisce alle donne, ai minori, alle coppie e alle famiglie, le prestazioni, anche domiciliari, mediche specialistiche, diagnostiche e terapeutiche, ostetriche, psicologiche e psicoterapeutiche, e riabilitative, mediante l’impiego di metodi e strumenti basati sulle più avanzate evidenze scientifiche necessarie ed appropriate nei seguenti ambiti di attività:
(…)
b) somministrazione dei mezzi necessari per la procreazione responsabile
(…)
i) consulenza, supporto psicologico e assistenza per problemi di sterilità e infertilità e per procreazione medicalmente assistita
(…)
Ultimi sviluppi in materia di tariffe
Dopo 6 anni dall’inserimento della PMA nei Livelli Essenziali di Assistenza, è stato appena approvato il nuovo decreto tariffe, con entrata in vigore prevista per il 1° gennaio 2024. In particolare, il decreto individua chiaramente tutte le prestazioni di procreazione medicalmente assistita (PMA) che saranno erogate a carico del SSN e che fino ad oggi potevano essere erogate solo in regime di ricovero.
Autori: la redazione di LO.LI Pharma

Prolasso del pavimento pelvico e livelli di vitamina D: stiamo facendo abbastanza? Un documento di ricerca
Obiettivo. Il prolasso degli organi pelvici (POP) è un problema comune che influisce negativamente sulla qualità della vita delle donne e richiede un’ampia gamma di passaggi di gestione che possono comportare seri interventi chirurgici. Questo studio mira a valutare una possibile relazione tra la presenza e la gravità del prolasso degli organi pelvici e i livelli di vitamina D. In questo studio non miriamo a valutare l’incidenza del prolasso del pavimento pelvico in Giordania.
Materiali e metodi. Questo era uno studio trasversale di donne non gravide con prolasso degli organi pelvici presentate alle cliniche ambulatoriali di ginecologia per la durata di 1 anno. La storia clinica completa e la valutazione ginecologica sono state registrate e correlate ai livelli plasmatici di vitamina D. È stato utilizzato un t-test indipendente per analizzare la possibile relazione tra livelli vitaminici e POP.
Risultati. Sono state reclutate centoquaranta donne, con un’età media di 42,1 ± 13,3 e una parità media di 5,73 ± 1,88. I livelli medi di vitamina D erano 12,8 ± 11,4, inferiori agli standard internazionali. I livelli sierici di vitamina D erano nettamente inferiori nel gruppo prolasso rispetto al gruppo non prolasso (p = 0,046). Inoltre, livelli più bassi di vitamina D correlano con manifestazione multisito (p = 0,022), rettocele (p = 0,007) e stadio avanzato (p = 0,053).
Conclusioni. Lo studio ha concluso che i pazienti con prolasso degli organi pelvici mostravano livelli di vitamina D inferiori rispetto a quelli senza prolasso. Inoltre, sembra che la carenza di vitamina D possa essere correlata in modo indipendente al prolasso multisito e ai gradi avanzati.
Il microbiota condiziona anche la performance sportiva
Il microbiota intestinale contribuisce direttamente alla crescita e allo sviluppo muscolo-scheletrico, soprattutto per via del legame esistente tra la popolazione microbiotica, gli acidi biliari e la massa muscolare. Come emerge anche dallo studio scientifico pubblicato su Trends in Microbiology nell’ottobre del 2022, la presenza di uno stato di disbiosi può interferire negativamente con la prestazione sportiva di medio e alto livello, oltre a rendere poco efficiente l’organismo nella sua totalità.
Anzitutto, il microbiota intestinale – quando in equilibrio – è in grado di regolare le funzioni dell’organismo, favorendo il suo benessere e contrastando gli stati patologici. Per esempio, favorisce il corretto svolgimento delle funzioni metaboliche e contribuisce al rafforzamento del sistema immunitario. Al contrario, le perturbazioni della sua composizione, come avviene nei casi di disbiosi intestinale, sono associate a un’ampia gamma di malattie.
In particolare, lo studio già citato ha indagato il legame tra il microbiota e gli acidi biliari, che come noto sono importanti molecole che condizionano il corretto svolgimento delle funzioni metaboliche dell’organismo. Si è visto, nello specifico, che i microbi presenti nell’intestino tenue e nel colon possono influenzare in maniera significativa la disponibilità e funzionalità degli acidi biliari, impattando negativamente sull’omeostasi metabolica dell’ospite e sulla massa muscolare scheletrica.
Pur essendoci ancora molte incertezze sul legame tra microbiota intestinale e atrofia muscolare scheletrica, è evidente che per mantenere un normale tasso di sintesi proteica è importante che il microbiota resti in equilibrio. Per questo motivo, la manipolazione della composizione batterica attraverso i probiotici può essere una strategia utile ed efficace per ritardare il processo di invecchiamento metabolico e dunque per migliorare le funzionalità dell’organismo. Incidendo, tra le altre cose, anche sulla performance associata all’attività sportiva.
Fonte: https//www.cell.com/trends/microbio842X(22)00286-4